Axit Clohydric (HCl): Cẩm nang toàn tập về tính chất, ứng dụng và an toàn
- 1. Axit HCl là gì? Khái niệm cơ bản
- 2. Tính chất vật lý đặc trưng của Axit HCl
- 3. Tính chất hóa học: Sức mạnh của một Axit điển hình
- 4. Đặc điểm nhận dạng Axit HCl
- 5. Quy trình sản xuất và Điều chế
- 6. Ứng dụng phổ biến của Axit HCl trong đời sống và công nghiệp
- 7. An toàn hóa chất: Những điều bắt buộc phải biết
- 8. Bảo quản và Lưu trữ Axit HCl
- 9. Mua Axit HCl ở đâu uy tín và chất lượng?
- 10. Kết luận
1. Axit HCl là gì? Khái niệm cơ bản

1.1. Định nghĩa và Tên gọi
Axit Clohydric là một dung dịch nước của khí Hydrogen Chloride (HCl). Trong các văn bản kỹ thuật và đời sống, nó còn được biết đến với các tên gọi khác như:
-
Axit Muriatic (tên gọi cổ).
-
Spirit of salt (Hồn của muối – do các nhà giả kim thuật đặt tên vì nó được điều chế từ muối ăn).
-
Axit Hydrocloric.
Công thức hóa học của nó là HCl. Đây là một axit vô cơ mạnh, là thành phần chính của dịch vị dạ dày giúp tiêu hóa thức ăn, và cũng là một tác nhân ăn mòn mạnh trong công nghiệp.
1.2. Cấu tạo phân tử
Phân tử HCl bao gồm một nguyên tử Hydro (H+) và một nguyên tử Clo (Cl-) liên kết với nhau bằng liên kết cộng hóa trị phân cực.
-
Độ dài liên kết H-Cl: Khoảng 127.4 pm.
-
Momen lưỡng cực: 1.08 D. Do sự chênh lệch độ âm điện giữa Clo (3.16) và Hydro (2.20), cặp electron dùng chung bị lệch hẳn về phía Clo, làm cho phân tử bị phân cực mạnh. Điều này giải thích tại sao khí HCl tan cực tốt trong nước để tạo thành dung dịch axit.
2. Tính chất vật lý đặc trưng của Axit HCl
Để nhận biết và sử dụng HCl hiệu quả, việc nắm vững các tính chất vật lý là điều tiên quyết.
2.1. Trạng thái và Màu sắc
-
Dạng khí: HCl ở dạng khan là một chất khí không màu, mùi hắc rất khó chịu và nặng hơn không khí.
-
Dạng dung dịch:
-
Dung dịch HCl loãng là chất lỏng không màu.
-
Dung dịch HCl đậm đặc (nồng độ cao nhất khoảng 38%) thường có màu vàng nhạt (do lẫn tạp chất sắt hoặc clo tự do) và bốc khói mạnh trong không khí ẩm. Làn khói này thực chất là các hạt nhỏ dung dịch axit được tạo ra khi khí HCl thoát ra kết hợp với hơi nước trong không khí.
-
| Nồng độ phần trăm (w/w) | Nồng độ mol (M) | Tỷ trọng (kg/l) | Điểm sôi (∘C) | Ghi chú |
| 10% | ~2.87 | 1.048 | 103 | Dung dịch loãng, ít bốc khói |
| 32% | ~10.17 | 1.159 | 84 | Loại phổ biến trong công nghiệp |
| 38% | ~12.39 | 1.189 | 48 | Nồng độ bão hòa tối đa, bốc khói cực mạnh |
3. Tính chất hóa học: Sức mạnh của một Axit điển hình
Axit Clohydric là một axit mạnh, có khả năng phân ly hoàn toàn trong nước:
HCl + H2O → H3O+ + Cl-
Dưới đây là 5 tính chất hóa học quan trọng nhất minh chứng cho sức mạnh của HCl.
3.1. Làm đổi màu chất chỉ thị
Đây là cách nhanh nhất để nhận biết môi trường axit.
-
Làm quỳ tím chuyển sang màu đỏ.
-
Không làm đổi màu dung dịch Phenolphthalein (do Phenolphthalein không màu trong môi trường axit và trung tính).
3.2. Tác dụng với kim loại (Phản ứng Oxi hóa - Khử)
HCl tác dụng với các kim loại đứng trước Hydro trong dãy hoạt động hóa học (như Mg, Fe, Al, Zn...) tạo thành muối clorua và giải phóng khí Hydro (H2).
Fe + 2HCl → FeCl2 + H2↑
(Lưu ý: Sắt tác dụng với HCl chỉ tạo ra muối Sắt (II) FeCl2, không tạo ra Sắt (III))
2Al + 6HCl → 2AlCl3 + 3H2↑
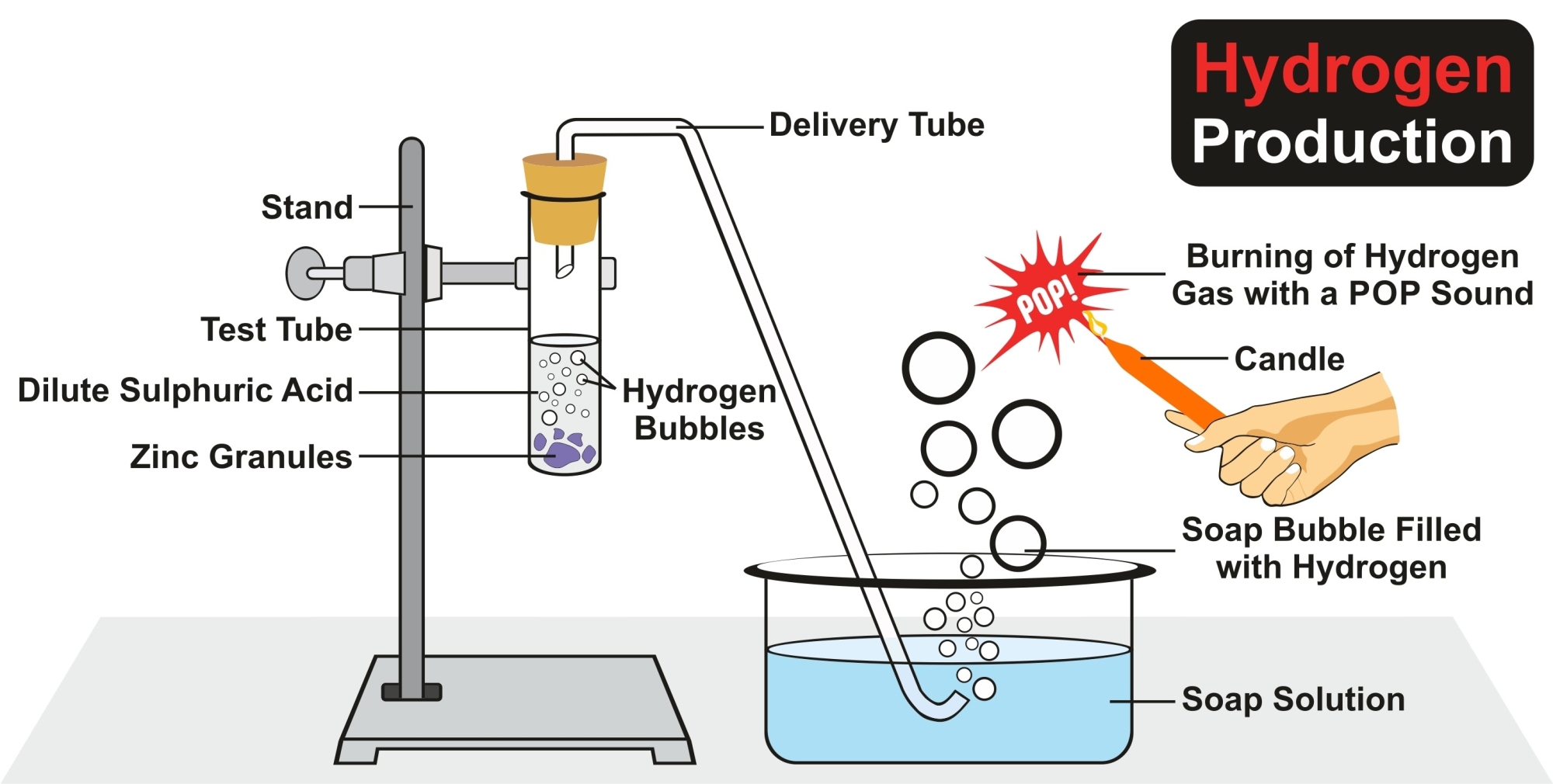
Ngoại lệ: HCl không tác dụng với các kim loại đứng sau Hydro như Đồng (Cu), Bạc (Ag), Vàng (Au), Bạch kim (Pt). Để hòa tan vàng, người ta phải dùng "nước cường toan" (hỗn hợp HCl và HNO3).
3.3. Tác dụng với Oxit kim loại (Oxit bazơ)
Đây là tính chất nền tảng cho ứng dụng tẩy gỉ thép. HCl phản ứng với oxit kim loại tạo ra muối và nước.
CuO (Đen) + 2HCl → CuCl2 (Xanh lá) + H2O
Fe2O3 (Gỉ sắt) + 6HCl → 2FeCl3 + 3H2O
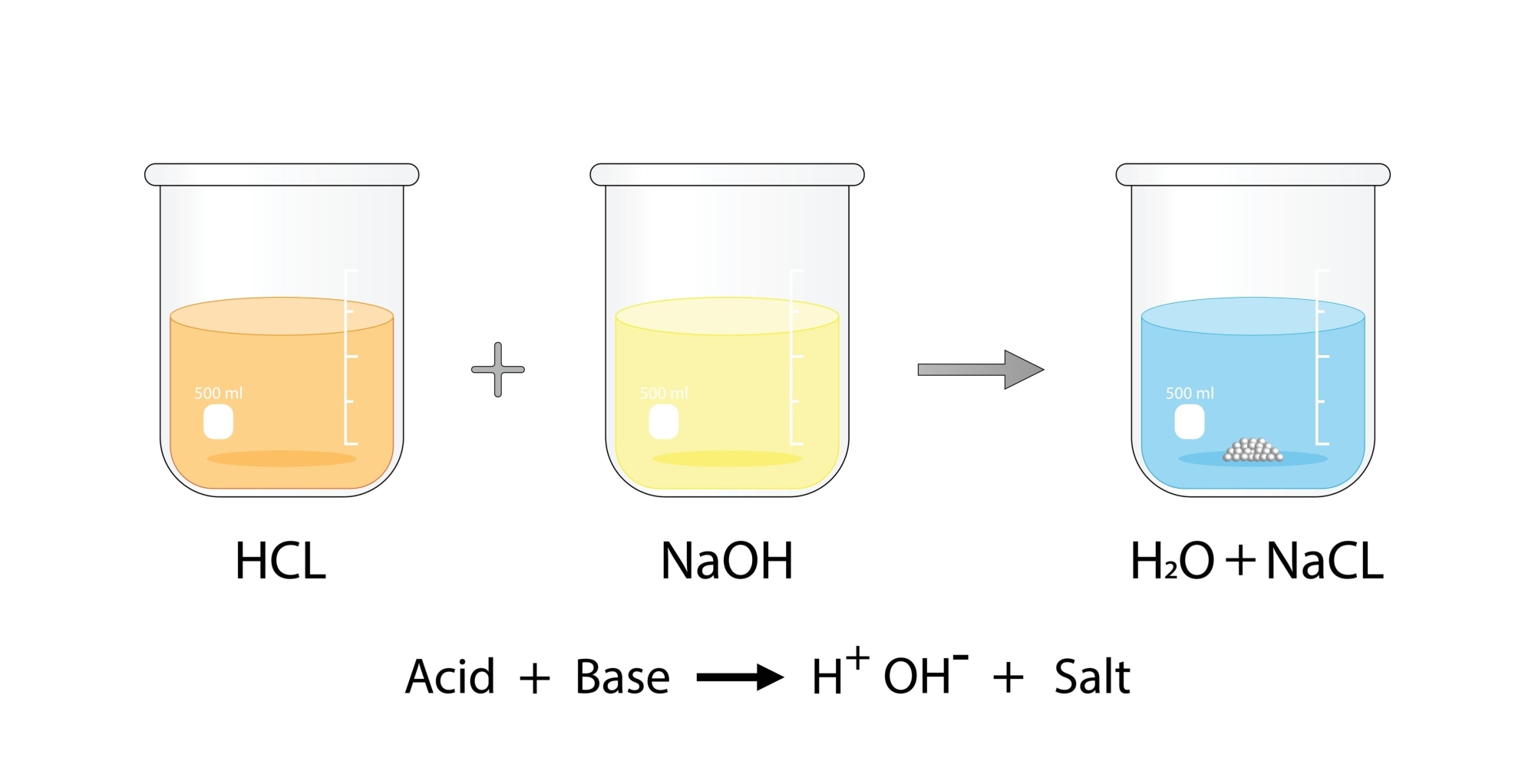
3.4. Tác dụng với Bazơ (Phản ứng trung hòa)
HCl phản ứng mãnh liệt với các bazơ để tạo thành muối và nước. Phản ứng này tỏa nhiệt mạnh.
NaOH + HCl → NaCl + H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
3.5. Tác dụng với muối
HCl tác dụng với muối của axit yếu hơn hoặc tạo thành kết tủa.
-
Với muối cacbonat: Sủi bọt khí CO2.
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
(Ứng dụng để tẩy cặn canxi trong ấm đun nước hoặc thiết bị vệ sinh)
-
Với muối Bạc nitrat: Tạo kết tủa trắng, hóa đen ngoài ánh sáng.
AgNO3 + HCl → AgCl↓ (trắng) + HNO3
4. Đặc điểm nhận dạng Axit HCl
Làm thế nào để phân biệt HCl với các loại axit khác như H2SO4 hay HNO3?
-
Dùng quỳ tím: Hóa đỏ (nhận biết là axit).
-
Dùng thuốc thử đặc trưng AgNO3:
-
Nhỏ vài giọt dung dịch Bạc Nitrat (AgNO3) vào ống nghiệm chứa axit cần thử.
-
Nếu xuất hiện kết tủa trắng vón cục (AgCl), không tan trong các axit mạnh khác, đó là axit HCl (hoặc muối Clorua).
-
Phương trình: Ag+ + Cl- → AgCl↓
-
-
Quan sát hiện tượng bốc khói: Axit HCl đậm đặc bốc khói mạnh trong không khí ẩm, trong khi H2SO4 đặc thì không bốc khói (nó hút ẩm) và HNO3 bốc khói màu nâu đỏ nếu bị phân hủy.
5. Quy trình sản xuất và Điều chế
Trong công nghiệp, HCl được sản xuất với quy mô hàng triệu tấn mỗi năm thông qua các phương pháp sau:
5.1. Tổng hợp trực tiếp (Phương pháp công nghiệp chính)
Đốt khí Clo (Cl2) trong khí Hydro (H2):
H2 + Cl2 —tº→ 2HCl
Phản ứng này tạo ra sản phẩm có độ tinh khiết rất cao, thường dùng cho ngành thực phẩm và dược phẩm.
5.2. Phản ứng từ Axit Sulfuric và Muối ăn (Phương pháp Sunfat)
Đây là phương pháp truyền thống, thường dùng trong phòng thí nghiệm hoặc quy mô nhỏ:
2NaCl + H2SO4 —500℃→ Na2SO4 + 2HCl↑
Hoặc ở nhiệt độ thấp hơn (< 250℃) tạo ra muối axit:
2NaCl + H2SO4 → Na2SO4 + 2HCl↑
5.3. Sản phẩm phụ của phản ứng clo hóa hợp chất hữu cơ
Hơn 90% lượng HCl sản xuất tại Mỹ và Châu Âu thực chất là sản phẩm phụ của quá trình sản xuất các chất hữu cơ (như PVC, teflon, v.v.).
Ví dụ trong phản ứng clo hóa hidrocacbon:
R–H + Cl2 → R–Cl + HCl
6. Ứng dụng phổ biến của Axit HCl trong đời sống và công nghiệp
Tại sao HCl lại quan trọng đến vậy? Hãy cùng khám phá các ứng dụng thực tiễn khổng lồ của nó.
6.1. Tẩy gỉ thép (Steel Pickling) – Ứng dụng lớn nhất
Trước khi thép được cán, mạ kẽm hay gia công, bề mặt của nó phải sạch hoàn toàn lớp gỉ sắt (oxit sắt). Axit HCl nồng độ khoảng 18% là lựa chọn số 1 cho quá trình này.
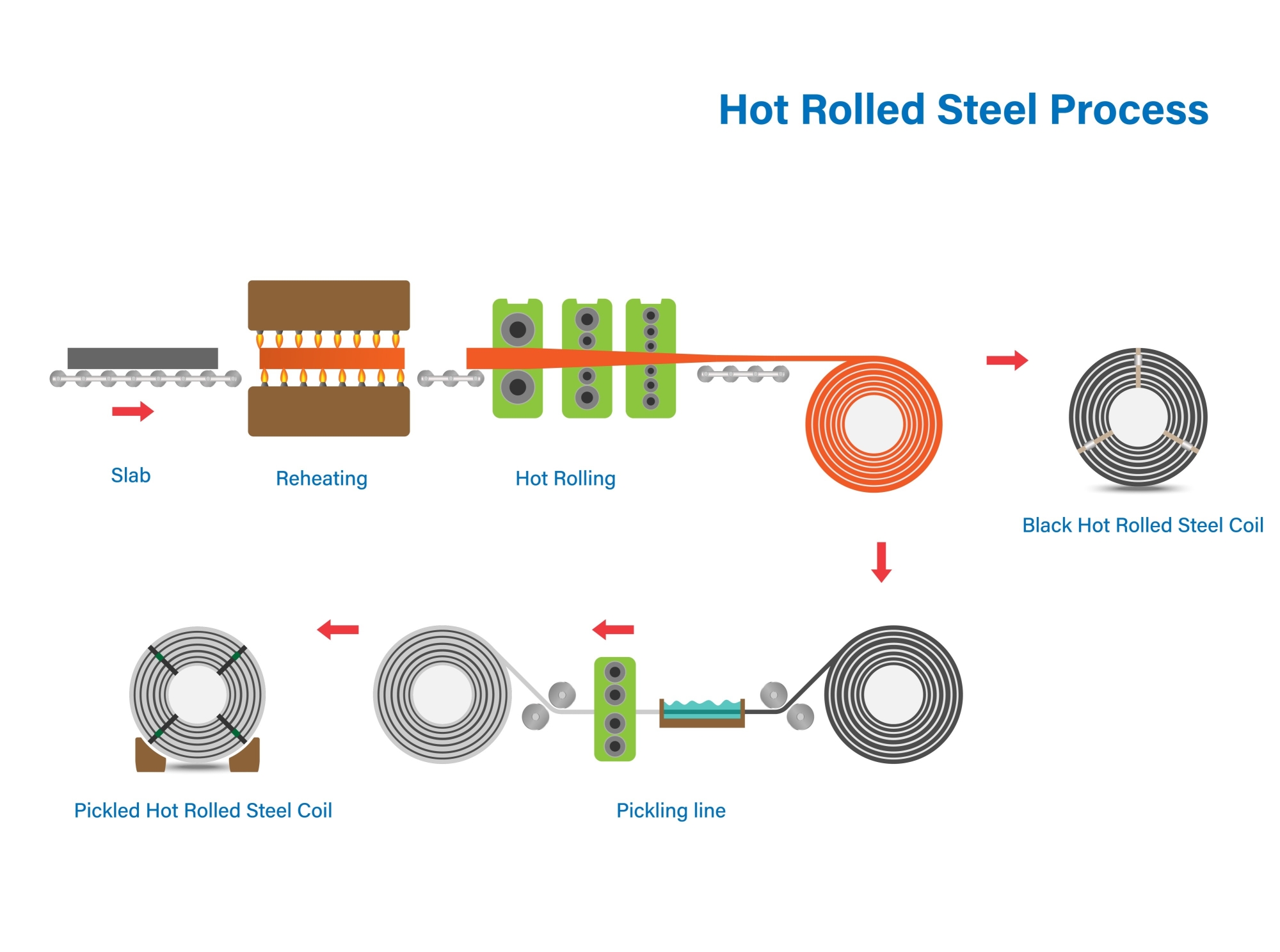
-
Ưu điểm so với H2SO4: Tốc độ tẩy gỉ nhanh hơn, bề mặt kim loại sạch và sáng hơn, hoạt động tốt ở nhiệt độ thấp hơn.
-
Phương trình: Fe2O3 + Fe + 6HCl → 3FeCl2 + 3H2O
6.2. Xử lý nước hồ bơi và nước thải
-
Cân bằng pH: HCl được dùng để hạ độ pH của nước hồ bơi khi nó quá cao (kiềm tính). Độ pH lý tưởng (7.2 - 7.6) giúp Clo hoạt động hiệu quả để diệt khuẩn và ngăn ngừa kích ứng da.
-
Xử lý nước thải: Trung hòa các dòng nước thải có tính kiềm cao trước khi xả ra môi trường.
6.3. Sản xuất các hợp chất vô cơ
Nhiều hóa chất xử lý nước quan trọng được sản xuất từ HCl:
-
Sắt (III) clorua (FeCl3) và Polyaluminium Chloride (PAC): Đây là các chất keo tụ (flocculation agents) dùng để lắng cặn, làm trong nước thải, nước uống và sản xuất giấy.
-
Canxi clorua (CaCl2): Dùng làm chất rải đường chống đóng băng (ở xứ lạnh) hoặc làm chất hút ẩm.
6.4. Công nghiệp thực phẩm
Bạn có thể bất ngờ, nhưng HCl (loại tinh khiết thực phẩm) đóng vai trò lớn trong những gì chúng ta ăn:
-
Thủy phân tinh bột và protein: Dùng trong sản xuất các loại sốt, nước tương, bột ngọt.
-
Sản xuất Gelatin: Giúp chiết xuất collagen từ xương động vật.
-
Điều chỉnh độ axit (pH): Trong các sản phẩm đóng hộp, nước giải khát.
6.5. Tái sinh nhựa trao đổi ion
Trong các hệ thống lọc nước tinh khiết hoặc làm mềm nước cứng, các hạt nhựa trao đổi ion sau một thời gian sẽ bị bão hòa. Người ta dùng dung dịch HCl chất lượng cao để rửa trôi các cation (Ca2+, Mg2+, Na+...) bám trên nhựa và thay thế chúng bằng ion H+, giúp hạt nhựa hoạt động trở lại.
6.6. Khai thác dầu khí
HCl được bơm vào các tầng đá của giếng dầu để hòa tan một phần đá vôi (CaCO3), tạo ra các lỗ rỗng lớn hơn. Quy trình này gọi là "axit hóa" (acidizing), giúp dầu mỏ chảy vào giếng khoan dễ dàng hơn, tăng sản lượng khai thác.
6.7. Vệ sinh nhà cửa
Dưới cái tên "Axit Muriatic", HCl loãng có mặt trong nhiều chất tẩy rửa bồn cầu, gạch men để loại bỏ các vết ố vàng cứng đầu và cặn vôi mà xà phòng thường không làm sạch được.
7. An toàn hóa chất: Những điều bắt buộc phải biết
Axit HCl là chất ăn mòn mạnh. Việc tiếp xúc trực tiếp có thể gây ra những hậu quả nghiêm trọng.

7.1. Các nguy hiểm tiềm ẩn
-
Với mắt: Dung dịch đậm đặc có thể gây mù lòa vĩnh viễn.
-
Với da: Gây bỏng hóa chất nặng, hoại tử mô, để lại sẹo.
-
Hô hấp: Hít phải hơi axit HCl gây ho, ngạt thở, viêm đường hô hấp, phù phổi. Tiếp xúc lâu dài gây mòn răng, viêm phế quản mãn tính.
7.2. Trang bị bảo hộ (PPE)
Khi làm việc với HCl, TUYỆT ĐỐI phải trang bị:
-
Kính bảo hộ chống hóa chất (Goggles).
-
Găng tay cao su hoặc nhựa PVC/Neoprene (chống axit).
-
Áo choàng phòng thí nghiệm hoặc quần áo bảo hộ chống axit.
-
Khẩu trang hoạt tính hoặc mặt nạ phòng độc (nếu làm việc với HCl đậm đặc bốc khói).
7.3. Sơ cứu khi gặp sự cố
-
Bắn vào mắt: Rửa ngay lập tức dưới vòi nước sạch liên tục ít nhất 15 phút. Giữ mí mắt mở rộng. Đến ngay cơ sở y tế.
-
Dính vào da: Cởi bỏ quần áo dính hóa chất. Rửa vùng da bị ảnh hưởng dưới vòi nước chảy ít nhất 15 phút. Không dùng xà phòng ngay lập tức nếu da bị rách.
-
Hít phải: Di chuyển nạn nhân ra nơi thoáng khí. Hô hấp nhân tạo nếu ngừng thở.
-
Nuốt phải: KHÔNG kích thích gây nôn (vì axit sẽ làm bỏng thực quản lần 2 khi trào ngược). Cho uống nhiều nước hoặc sữa. Đến bệnh viện ngay.
8. Bảo quản và Lưu trữ Axit HCl
Lưu trữ HCl sai cách có thể dẫn đến rò rỉ, phá hủy kho bãi và nguy hiểm cho con người.
-
Vật liệu chứa: Phải dùng các vật liệu kháng axit như nhựa PVC, nhựa composite (FRP), nhựa PE, cao su. Tuyệt đối không đựng trong thùng kim loại (sắt, kẽm, nhôm) vì axit sẽ ăn mòn thủng bình chứa.
-
Môi trường: Kho chứa phải thoáng mát, khô ráo, tránh ánh nắng trực tiếp. Nền kho phải làm bằng vật liệu chịu axit.
-
Quy cách: Thùng chứa phải đậy nắp kín để tránh bay hơi khí HCl độc hại ra môi trường. Cần có đê bao xung quanh khu vực bồn chứa để ngăn chặn sự cố tràn đổ.
9. Mua Axit HCl ở đâu uy tín và chất lượng?

Trên thị trường hiện nay có rất nhiều đơn vị cung cấp Axit Clohydric với các nồng độ khác nhau. Tuy nhiên, để đảm bảo an toàn và hiệu quả sản xuất, việc lựa chọn nhà cung cấp uy tín là rất quan trọng. Công ty TNHH Hóa Chất Thành Phát là đơn vị phân phối axit Clohydric (HCl) uy tín đảm bảo chất lượng, hàm lượng theo tiêu chuẩn kỹ thuật với nồng độ và khối lượng theo yêu cầu của khách hàng.
Hóa chất Thành Phát đáp ứng đầy đủ các tiêu chí:
-
Có giấy phép kinh doanh hóa chất theo quy định của Bộ Công Thương.
-
Cung cấp đầy đủ Phiếu an toàn hóa chất (MSDS) và Chứng nhận phân tích (COA).
-
Hệ thống vận chuyển chuyên dụng, đảm bảo an toàn cháy nổ và rò rỉ.
-
Tư vấn kỹ thuật rõ ràng về cách pha chế và sử dụng.
10. Kết luận
Axit HCl (Hydrochloric Acid) là "con dao hai lưỡi". Nó là công cụ đắc lực không thể thiếu trong sự phát triển của nền công nghiệp hiện đại, từ luyện kim đến thực phẩm. Tuy nhiên, sự nguy hiểm của nó đòi hỏi người sử dụng phải có kiến thức vững vàng và tuân thủ nghiêm ngặt các quy tắc an toàn.
Hy vọng bài viết này đã cung cấp cho bạn cái nhìn tổng quan và sâu sắc nhất về Axit HCl. Nếu bạn đang tìm kiếm nguồn cung cấp hóa chất chất lượng hoặc cần tư vấn giải pháp xử lý nước bằng HCl, hãy liên hệ ngay với chúng tôi để được hỗ trợ tốt nhất.
Câu hỏi thường gặp (FAQ)
1. Axit HCl có ăn mòn nhựa không? Phần lớn các loại nhựa thông dụng như PE, PVC, PP đều chịu được axit HCl. Do đó, người ta thường dùng can nhựa để đựng axit này. Tuy nhiên, một số loại nhựa kỹ thuật hoặc cao su kém chất lượng có thể bị ảnh hưởng theo thời gian.
2. Làm sao để pha loãng axit HCl đậm đặc an toàn? Luôn tuân thủ nguyên tắc: "Đổ Axit vào Nước" (Rót từ từ axit vào nước và khuấy nhẹ). TUYỆT ĐỐI KHÔNG đổ nước vào axit đậm đặc, vì phản ứng tỏa nhiệt mạnh sẽ làm nước sôi đột ngột và bắn axit ra ngoài gây bỏng.
3. Axit dạ dày có phải là axit HCl không? Đúng vậy. Dịch vị dạ dày người chứa axit HCl với nồng độ khoảng 0.05% - 0.1% (pH từ 1.5 - 3.5), giúp tiêu diệt vi khuẩn trong thức ăn và hoạt hóa các enzyme tiêu hóa protein.
Số lần xem: 182









