Axit Sunfuric đặc 98% (H2SO4): vua của các loại hóa chất
- 1. Axit Sunfuric 98% là gì?
- 2. Tính chất vật lý đặc trưng: Nhận diện "Vua Axit"
- 3. Tính chất hóa học: Sức mạnh hủy diệt của H2SO4 98%
- 4. Công nghệ sản xuất: Quy trình tiếp xúc (Contact Process)
- 5. Ứng dụng toàn diện trong đời sống và công nghiệp
- 6. An toàn tuyệt đối: Quy tắc sống còn
- 7. Bảo quản và Lưu trữ
- 8. Kết luận: Lựa chọn nhà cung cấp uy tín
Trong lịch sử phát triển của ngành công nghiệp hóa chất thế giới, chưa có một hợp chất nào nắm giữ vị trí độc tôn và quan trọng như Axit Sunfuric (H2SO4). Người ta thường nói: "Muốn biết nền công nghiệp của một quốc gia mạnh đến đâu, hãy nhìn vào sản lượng Axit Sunfuric mà quốc gia đó tiêu thụ".
Đặc biệt, Axit Sunfuric 98% (hay còn gọi là Axit Sunfuric đậm đặc) là dạng thương phẩm quan trọng nhất, mang trong mình sức mạnh hóa học khủng khiếp: vừa là một axit siêu mạnh, vừa là chất hút nước háo hức, vừa là chất oxi hóa mãnh liệt.
Bài viết này sẽ là một cẩm nang toàn diện, cung cấp cho bạn kiến thức từ A-Z về Axit Sunfuric 98%: Từ cấu tạo phân tử, những thí nghiệm "than hóa" kinh điển, cho đến vai trò không thể thay thế trong sản xuất phân bón, ắc quy và xử lý nước thải.
1. Axit Sunfuric 98% là gì?
1.1. Định nghĩa và Cấu tạo
Axit Sunfuric là một axit vô cơ gồm các nguyên tố Lưu huỳnh (S), Oxy (O) và Hydro (H). Công thức hóa học là H2SO4.
Về cấu trúc, nguyên tử Lưu huỳnh nằm ở trung tâm, liên kết với 2 nhóm Hydroxyl (-OH) và 2 nguyên tử Oxy bằng liên kết đôi. Ở trạng thái đậm đặc 98%, dung dịch này chứa 98% là phân tử H2SO4 và chỉ có 2% là nước. Đây là nồng độ bão hòa ổn định nhất trong điều kiện thương mại.
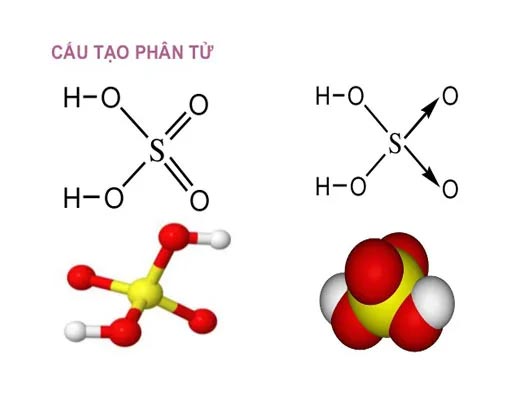
Cấu trúc phân tử Axit Sunfuric (H2SO4) với nguyên tử Lưu huỳnh (vàng) ở trung tâm liên kết với 4 nguyên tử Oxy (đỏ) và 2 nguyên tử Hydro (trắng).
1.2. Tại sao gọi là "Dầu của Vitriol"?
Trước khi có tên gọi hóa học hiện đại, các nhà giả kim thuật thời trung cổ gọi H2SO4 là "Dầu Vitriol" (Oil of Vitriol). Sở dĩ có tên này là vì nó được điều chế bằng cách nhiệt phân "Vitriol xanh" (Đồng sunfat ngậm nước) và sản phẩm thu được là chất lỏng sánh, nhớt giống như dầu thực vật.

Tinh thể Đồng Sunfat (Blue Vitriol) - nguồn gốc tên gọi cổ xưa của axit sunfuric.
2. Tính chất vật lý đặc trưng: Nhận diện "Vua Axit"
Khác với Axit Clohydric (HCl) hay Axit Nitric (HNO3) thường dễ bay hơi và bốc khói, Axit Sunfuric đặc có những tính chất vật lý rất riêng biệt:
2.1. Trạng thái và Màu sắc
-
Dạng lỏng sánh: H2SO4 98% là chất lỏng sánh như dầu, không màu (hoặc hơi ngả vàng xám nếu là hàng công nghiệp lẫn tạp chất).
-
Không bay hơi: Nó rất khó bay hơi ở nhiệt độ thường, do đó không có hiện tượng "bốc khói" mù mịt như HCl đậm đặc.
2.2. Tỷ trọng và Độ nhớt
-
Rất nặng: Khối lượng riêng của H2SO4 98% là 1.84 g/cm3. Điều này có nghĩa là 1 lít axit sunfuric đặc nặng tới 1.84 kg, gần gấp đôi nước. Khi cầm can axit này, bạn sẽ thấy rất đầm tay.
-
Độ nhớt cao: Do các liên kết hydro liên phân tử rất mạnh, axit này chảy chậm và nhớt.
2.3. Tính tan và Nhiệt độ sôi
-
Tan vô hạn trong nước: Nó có thể tan trong nước theo bất kỳ tỷ lệ nào.
-
Nhiệt độ sôi cao: Khoảng 337℃. Điểm sôi cao này giúp nó được dùng để điều chế các axit dễ bay hơi khác (như đẩy HCl ra khỏi muối).
3. Tính chất hóa học: Sức mạnh hủy diệt của H2SO4 98%
Axit Sunfuric đặc nóng thể hiện 3 tính chất hóa học chủ đạo làm nên tên tuổi của nó: Tính Axit mạnh, Tính Oxi hóa mạnh và Tính Háo nước.
3.1. Tính háo nước (Dehydration) - "Ma cà rồng" hút ẩm
Đây là tính chất nguy hiểm nhất gây ra các vụ bỏng axit kinh hoàng. H2SO4 đặc có ái lực cực lớn với nước. Nó không chỉ hút nước tự do mà còn "giật" các nguyên tố Hydro và Oxy từ các hợp chất hữu cơ để tạo thành nước.
Thí nghiệm kinh điển: "Than hóa" đường (Sugar Snake)
Khi nhỏ H2SO4 đặc vào đường kính trắng (Saccarozơ - C12H22O11):
C12H22O11 —H2SO4 đặc→ 12C (Than đen) + 11H2O
Axit hút hết nước, để lại khối than đen xốp. Một phần cacbon tiếp tục bị axit oxi hóa tạo khí SO2 và CO2, đẩy khối than trào lên như một con rắn đen.
Thí nghiệm "Rắn Carbon" minh họa tính háo nước khủng khiếp: Axit sunfuric biến đường trắng thành than đen xốp trào lên cốc.
Cảnh báo: Nếu dính vào da, axit sẽ hút nước của tế bào, đốt cháy da thành than, gây đau đớn tột cùng và để lại sẹo vĩnh viễn.
3.2. Tính Oxi hóa mạnh (Strong Oxidizer)
Khác với H2SO4 loãng (chỉ tác dụng với kim loại đứng trước H), H2SO4 đặc, nóng có thể hòa tan hầu hết các kim loại (trừ vàng Au và bạch kim Pt).
-
Với kim loại Đồng (Cu):
Cu + H2SO4 —(đặc, nóng)→ CuSO4 + SO2↑ + 2H2O
(Kim loại tan ra, tạo dung dịch xanh lam và khí mùi hắc).
-
Với phi kim (C, S, P):
C + H2SO4 —(đặc)→ CO2 ↑ + 2SO2 ↑ + 2H2O
3.3. Hiện tượng thụ động hóa
Cần lưu ý đặc biệt: H2SO4 đặc nguội làm thụ động hóa Nhôm (Al) và Sắt (Fe). Nó tạo ra một lớp màng oxit bền vững bảo vệ kim loại khỏi bị ăn mòn tiếp.
→ Ứng dụng: Người ta dùng các bồn chứa bằng thép hoặc bồn sắt tây để vận chuyển axit sunfuric đặc nguội.
4. Công nghệ sản xuất: Quy trình tiếp xúc (Contact Process)
Để tạo ra lượng axit khổng lồ phục vụ thế giới, công nghiệp sử dụng Quy trình tiếp xúc (Contact Process) gồm 3 giai đoạn chính:
-
Sản xuất SO2: Đốt lưu huỳnh hoặc quặng pirit sắt (FeS2) trong không khí.
S + O2 —tº→ SO2
-
Oxi hóa SO2 thành SO3: Đây là bước quan trọng nhất, sử dụng chất xúc tác V2O5 (Vanadi oxit) ở 450℃.
2SO2 + O2 ⇌ 2SO3
-
Hấp thụ SO3: Người ta không dùng nước để hấp thụ trực tiếp SO3 (vì sẽ tạo sương mù axit khó ngưng tụ). Thay vào đó, dùng H2SO4 98% để hấp thụ SO3 tạo thành Oleum (H2SO4•SO3).
H2SO4+ nSO3 → H2SO4•SO3
Sau đó, dùng nước pha loãng Oleum để thu được H2SO4 98% thương phẩm.
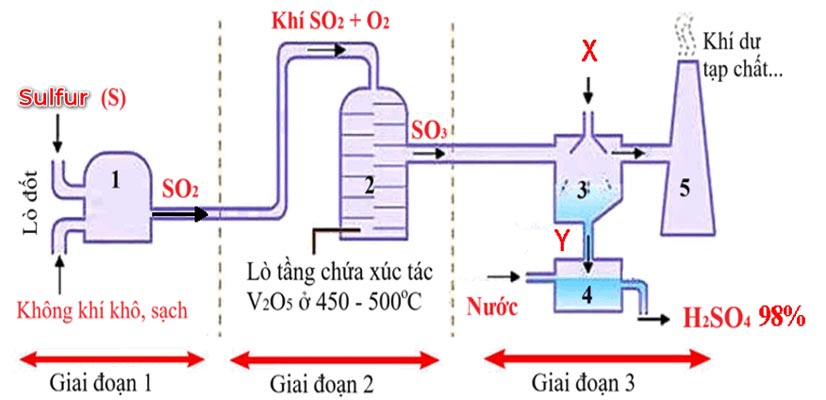
Sơ đồ điều chế Axit Sunfuric H2SO4 98% trong công nghiệp
5. Ứng dụng toàn diện trong đời sống và công nghiệp
Tại sao H2SO4 là "Vua"? Vì nó tham gia vào hầu hết mọi quy trình sản xuất.
5.1. Sản xuất Phân bón (Chiếm 60% sản lượng toàn cầu)
Ứng dụng lớn nhất của axit sunfuric là sản xuất axit photphoric (H3PO4) để làm phân lân.
-
Superphotphat: Dùng H2SO4 tác dụng với quặng apatit để tạo ra phân lân giúp cây trồng phát triển rễ và ra hoa.
-
Amoni Sunfat (NH4)2SO4: Một loại phân đạm quan trọng.
5.2. Xử lý nước thải
Trong các hệ thống xử lý nước, H2SO4 đóng vai trò là chất điều chỉnh pH.
-
Trung hòa: Nước thải từ các ngành dệt nhuộm, giấy thường có tính kiềm cao (pH > 7). H2SO4 được bơm vào để trung hòa pH về mức tiêu chuẩn (6.5 - 8.5) trước khi xả ra môi trường.
-
Sản xuất Phèn nhôm: Dùng để sản xuất Al2(SO4)3 – chất keo tụ giúp làm trong nước.
5.3. Công nghiệp Luyện kim và Tẩy gỉ (Pickling)
Tương tự HCl, H2SO4 được dùng để tẩy sạch lớp gỉ oxit sắt trên bề mặt thép trước khi mạ kẽm, tráng thiếc hoặc sơn phủ. Tuy nhiên, quá trình này thường thực hiện với axit loãng nóng.
5.4. Sản xuất Ắc quy Chì (Lead-Acid Batteries)
Đây là ứng dụng quen thuộc nhất với người tiêu dùng. Dung dịch trong bình ắc quy xe máy, ô tô chính là axit sunfuric loãng (khoảng 30-33%). Nó đóng vai trò là chất điện ly giúp phản ứng điện hóa sinh ra dòng điện.
5.5. Công nghiệp Lọc dầu
Trong quá trình tinh chế dầu mỏ, H2SO4 được dùng làm chất xúc tác cho phản ứng alkyl hóa (alkylation) để tạo ra xăng có chỉ số octane cao.
5.6. Sản xuất các hóa chất khác
H2SO4 đặc là "axit mẹ" dùng để đẻ ra các "axit con" yếu hơn hoặc dễ bay hơi hơn:
-
Điều chế Axit Clohydric (HCl) từ muối ăn.
-
Điều chế Axit Nitric (HNO3) từ muối nitrat.
-
Sản xuất thuốc nổ (TNT), thuốc nhuộm, tơ sợi nhân tạo (tơ Rayon).
6. An toàn tuyệt đối: Quy tắc sống còn
Làm việc với H2SO4 98% không có chỗ cho sai lầm. Bạn cần thuộc lòng các quy tắc sau:
6.1. Quy tắc pha loãng: "Axit vào Nước" (A-N)
Đây là quy tắc vàng trong hóa học.
-
SAI: Đổ nước vào Axit. → Nước nhẹ hơn axit sẽ nổi lên trên. Phản ứng tỏa nhiệt cực mạnh làm nước sôi ngay lập tức, bắn axit đậm đặc ra ngoài gây bỏng mặt.
-
ĐÚNG: Rót từ từ Axit vào Nước và khuấy nhẹ. → Axit nặng hơn sẽ chìm xuống đáy, nhiệt lượng tỏa ra được khối nước lớn hấp thụ và tản nhiệt đều.
6.2. Trang bị bảo hộ (PPE)
-
Kính bảo hộ chống hóa chất (Goggles) + Mặt nạ che mặt (Face shield).
-
Găng tay chống axit chuyên dụng (Butyl rubber hoặc Neoprene).
-
Quần áo bảo hộ dài tay, tạp dề nhựa.
-
Giày bảo hộ chống hóa chất.
6.3. Sơ cứu khi bị dính axit sunfuric đặc
Lưu ý quan trọng: Sơ cứu H2SO4 đặc hơi khác với axit thường do tính háo nước tỏa nhiệt.
-
Nếu dính nhiều: Dùng khăn khô hoặc vải sạch thấm nhanh bớt axit trên da (tránh chà xát mạnh). Việc này giúp giảm lượng axit phản ứng với nước khi rửa, hạn chế nhiệt độ tăng cao gây bỏng nhiệt thêm.
-
Rửa nước: Sau khi thấm bớt, xả nước mát nhẹ nhàng liên tục lên vùng bị thương ít nhất 20-30 phút.
-
Tuyệt đối không: Không chườm đá lạnh (gây sốc nhiệt), không bôi kem đánh răng hay mỡ trăn.
-
Đến bệnh viện ngay lập tức.
7. Bảo quản và Lưu trữ
-
Vật liệu chứa: Với H2SO4 98% (đậm đặc), có thể dùng bồn chứa bằng thép cacbon (do hiện tượng thụ động hóa) hoặc nhựa chuyên dụng (HDPE, Composite FRP).
-
Nắp kín: Axit này hút ẩm rất mạnh. Nếu mở nắp, nó sẽ hút hơi nước trong không khí, làm loãng axit và thể tích dung dịch tăng lên có thể gây tràn.
-
Khu vực kho: Phải khô ráo, thoáng mát, có đê bao chống tràn và tách biệt với các chất dễ cháy, các chất khử và bazơ mạnh.
8. Kết luận: Lựa chọn nhà cung cấp uy tín
Axit Sunfuric H2SO4 98% là "trái tim" của nhiều dây chuyền sản xuất. Việc sử dụng đúng cách mang lại lợi ích kinh tế khổng lồ, nhưng sự bất cẩn có thể trả giá đắt.
Tại Công ty TNHH Hóa Chất Thành Phát, chúng tôi hiểu rõ tầm quan trọng của chất lượng và an toàn. Chúng tôi cung cấp:
-
Axit Sunfuric H2SO4 98% chất lượng công nghiệp, đảm bảo nồng độ chuẩn.
-
Xe bồn chuyên dụng vận chuyển an toàn đến tận nhà máy.
-
Tư vấn kỹ thuật về pha loãng, lưu trữ và xử lý sự cố.
Nếu bạn đang tìm kiếm nguồn cung cấp hóa chất ổn định cho hệ thống xử lý nước hay dây chuyền sản xuất, hãy liên hệ ngay tới Hotline 0987 991 688 để nhận tư vấn và báo giá tốt nhất.

Mẫu axit Sunfuric H2SO4 tại xe Thành Phát khi giao cho khách hàng
Câu hỏi thường gặp (FAQ)
1. H2SO4 đặc có ăn mòn nhựa không?
Hầu hết các loại nhựa thông thường như PET có thể bị axit sunfuric đặc nóng phá hủy. Tuy nhiên, nhựa HDPE, PP hay Teflon (PTFE) chịu được axit này ở nhiệt độ thường rất tốt. Đó là lý do can nhựa đựng axit thường làm từ HDPE dày.
2. Làm sao phân biệt H2SO4 đặc và loãng?
Ngoài việc dùng máy đo tỷ trọng (axit đặc nặng hơn nhiều), ta có thể quan sát hiện tượng tỏa nhiệt khi pha vào nước. Hoặc dùng thí nghiệm với Đồng (Cu): Axit loãng không tác dụng, Axit đặc nóng làm tan đồng và sinh khí SO2.
3. Tại sao H2SO4 đặc lại làm vải bị thủng lỗ đen?
Sợi vải (cotton) có thành phần chính là xenlulozơ (C6H10O5)n. Do tính háo nước, axit sunfuric hút nước của sợi vải, biến nó thành than (Cacbon) màu đen và mủn ra, tạo thành các lỗ thủng.
Số lần xem: 43









